Цитата:
Сообщение от anyk99
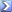
Перенос активированных ЖК внутрь мембран требует не только массы карнитина, но и существенного градиента АТФ.
|
Спасибо за ссылку. Со стартом разобрался: без глюкозы - никуда. Тем более, что
"В отличие от пирувата ацетил-КоА не является анаплеротическим метаболитом у высших животных. Его углеродный скелет полностью окисляется до CO2 и поэтому не принимает участия в биосинтезе. Поскольку при деградации жирных кислот образуется ацетил-КоА, клетки животных не в состоянии превращать жирные кислоты в глюкозу. Поэтому при голодании в организме прежде всего утилизируются не жиры, а белки."
Но вот после старта окисления кетоновых тел, синтезируемых в печени -
"Кетоновые тела образуются в печени. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными. Во-первых, в обычных условиях промежуточными продуктами β-окисления жирных кислот являются КоА-эфиры этих кислот, например β-окси-бутирил-КоА, ацетоацетил-КоА. Во-вторых, β-оксибутирил-КоА, образующийся в печени при β-окислении жирных кислот, имеет L-конфигурацию, в то время как β-оксибутират, обнаруживаемый в крови, представляет собой D-изомер. Именно β-окси-бутират D-конфигурации образуется в ходе метаболического пути синтеза β-окси-β-метилглутарил-КоА (3-гидрокси-3-метилглутарил-КоА)"
- после старта что происходит? Являтся ли процесс окисления кетоновых тел внутри митохондрии энергетически выгодным? Или неоглюкогенез, основанный на утилизации белков - единственный выход для голодающего организма? Или оба процесса - окисление кетоновых тел и неоглюкогенез идут одновременно и за счёт этого жир пускается в дело с толком?