|
|
#1 |
|
Администратор
Регистрация: Nov 2006
Адрес: Израиль
Сообщений: 9,349
Поблагодарил: 713
Поблагодарили 6,072 раз(а) в 6,722 сообщениях Файловый архив: 54
Закачек: 12
|
Биохимия голодания (слабонервным не читать!) (Ха! Это вы еще цикл Кребса (он же цикл трикарбоновых кислот, он же дыхательный цикл) не видели) Прежде всего, хотелось бы отметить, что конкретные цифры могут сильно отличаться в разных исследованиях и источниках (до двух раз). Очевидно это зависит от участников, их веса, состояния здоровья, режима и т.д. Перефразируя Льва Толстого можно сказать, что все здоровые люди здоровы одинаково, а все больные – больны по своему. Существующие темы на форуме: Ацидотический криз Гликоген для голодания Биохимия http://www.xumuk.ru/biochem/124.html В. Свободная энергия гидролиза высокоэнергетических связей Предположительно в физиологических условиях энергия гидролиза АТФ до АДФ и неорганического фосфата равна примерно -50 кДж/моль. http://www.xumuk.ru/biochem/138.html А. Цитратный цикл Большая часть потребляемого в цитратном цикле ацетил-КоА получает ацетильные остатки, образовавшиеся в результате бета-окисления жирных кислот (т.е. 90% жира) (см. с. 166) и окислительного декарбоксилирования пирувата, катализируемого пируватдегидрогеназой (см. с. 136). Оба процесса протекают в матриксе митохондрий. http://www.xumuk.ru/biochem/140.html Цитратный цикл: функции клетки животных не в состоянии превращать жирные кислоты в глюкозу. Поэтому при голодании в организме прежде всего утилизируются не жиры, а белки. Высвободившиеся аминокислоты, напротив, могут превращаться и в жирные кислоты, и в глюкозу и, тем самым, поддерживать уровень сахара в крови (см. с. 300). (т.е. белки (читай мышцы) более универсальное топливо) Дополнительная информация В растениях и бактериях ацетил-КоА превращается в сукцинат в так называемом глиоксилатном цикле, тесно связанном с цитратным циклом. Эти организмы способны осуществлять анаплеротическую деградацию нейтральных жиров. В растениях глиоксилатный путь локализован в особых органеллах, глиоксисомах. (а вот бактерии и растения могут питаться жирами) http://www.xumuk.ru/biochem/148.html А. Аэробное и анаэробное окисление глюкозы В присутствии кислорода (в аэробных условиях) большинство клеток животных получают энергию за счет полного разрушения питательных веществ (липидов, аминокислот и углеводов), т. е. за счет окислительных процессов. В отсутствие кислорода (анаэробные условия) клетка может синтезировать АТФ (АТР) только за счет гликолитического разрушения глюкозы. Хотя такое разрушение глюкозы, заканчивающееся образованием лактата, дает незначительную энергию для синтеза АТФ, этот процесс имеет решающее значение для существования клеток при недостатке или в отсутствие кислорода. Жирные кислоты в виде ацилкарнитина попадают в матрикс митохондрий (см. с. 214), где подвергаются бета-окислению с образованием ацил-КоА (см. с. 166). Глюкоза в цитоплазме превращается в пируват путем гликолиза (см. с. 148). Пируват транспортируется в митохондриальный матрикс, где декарбоксилируется пируватдегидрогеназным комплексом (см. с. 136) с образованием ацетил-КоА. … Образующиеся из жирных кислот ацетильные остатки окисляются до CO2 в цитратном цикле (см. с. 138). Деградация аминокислот также приводит к ацетильным остаткам или продуктам, которые непосредственно включаются в цитратный цикл (см. с. 182). В отсутствие кислорода, т. е. в анаэробных условиях картина полностью меняется. … Поскольку энергия уже не может быть получена за счет деградации аминокислот, клетка становится полностью зависимой в энергетическом отношении от потребления глюкозы при гликолизе. … в клетках животных, функционирующих в анаэробных условиях, пируват восстанавливается до лактата, который поступает в кровь. … Продукция АТФ при этих процессах незначительна: при образовании лактата возникают только 2 молекулы АТФ на молекулу глюкозы. http://www.xumuk.ru/biochem/156.html Глюконеогенез Некоторые ткани, такие, как мозг и эритроциты, зависят от постоянного снабжения глюкозой. (это в «мирное время». На голоде мозг и нервы питаются и кетонами) Если получаемое с пищей количество углеводов недостаточно, необходимая концентрация глюкозы в крови может поддерживаться некоторое время за счет расщепления гликогена печенью (см. с. 158). Если истощены также и эти запасы, в печени запускается синтез глюкозы de novo, глюконеогенез (см. с. 302). Наряду с печенью высокой глюконеогенезной активностью обладают также клетки почечных канальцев (см. с. 320). Исходными соединениями в глюконеогенезе являются аминокислоты мышечной ткани. При длительном голодании это приводит к массивному распаду мышечного белка. Другими важными исходными веществами для синтеза глюкозы служат лактат, образующийся в эритроцитах и мышечной ткани при недостатке О2 (т.е. при интенсивных нагрузках), а также глицерин, образующийся при расщеплении жиров. Напротив, жирные кислоты не могут трансформироваться в глюкозу в организме животных, так как в данном случае деградация жирных кислот не является анаплеротическим процессом (см. с. 140). В организме человека за счет глюконеогенеза образуется несколько сотен граммов глюкозы в сутки. http://www.xumuk.ru/biochem/158.html Б. Баланс гликогена В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное — главным образом в мышцах. Содержание гликогена в других органах незначительно. Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови в фазе пострезорбции (см. с. 300). Поэтому содержание гликогена в печени варьирует в широких пределах. При длительном голодании оно падает почти до нуля, после чего начинается снабжение организма глюкозой с помощью глюконеогенеза (см. с. 156). Гликоген мышц служит резервом энергии и не участвует в регуляции уровня глюкозы в крови. В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. (но при нагрузке он дает молочную кислоту, которая идет в дело в печени) По этой причине колебания содержания гликогена в мышцах меньше, чем в печени. http://www.xumuk.ru/biochem/164.html Деградация жирных кислот в печени Наиболее важным процессом деградации жирных кислот является бета-окисление (см. рис. 167) в митохондриях. При этом жирные кислоты вначале активируются в цитоплазме, присоединяясь к коферменту А [3]. Затем они с помощью транспортной системы (карнитинового челнока [4]; см. рис. 215) попадают в митохондриальный матрикс, где разрушаются в результате бета-окисления до ацетил-КоА. Образующиеся ацетильные остатки полностью окисляются до СО2 в цитратном цикле с освобождением энергии в виде АТФ (АТР).(при наличии углеводов или аминокислот. В последнем не уверен.) Если количество образовавшегося ацетил-КоА превосходит энергетическую потребность гепатоцитов, что наблюдается при высоком содержании жирных кислот в плазме крови (типичные случаи — голодание и сахарный диабет), то в гепатоцитах синтезируются кетоновые тела (см. рис. 305), снабжающие энергией уже другие ткани. http://www.xumuk.ru/biochem/166.html Деградация жирных кислот: бета-окисление А. Деградация жирных кислот: бета-окисление После попадания в клетки жирные кислоты активируются путем образования ацил-КоА Для этого нужны две богатые энергией ангидридные связи АТФ (см. с. 112). В матрикс митохондрий активированные жирные кислоты попадают в виде ацилкарнитина, который является трансмембранным переносчиком (см. с. 214). Деградация жирных кислот происходит в митохондриальном матриксе путем окислительного цикла реакций, при котором последовательно отщепляются С2-звенья в виде ацетил-КоА (активированной уксусной кислоты). Продуктами реакции являются ацетил-КоА и активированная жирная кислота, углеродная цепь которой короче на два углеродных атома по сравнению с длиной цепи исходной жирной кислоты. ……………………………………………………………………………………………………………………………… Для полной деградации длинноцепочечной жирной кислоты цикл должен многократно повторяться; например, для стеарил-КоА (18:0) необходимы восемь циклов. Образующийся ацетил-КоА может переноситься на оксалоацетат с образованием цитрата, промежуточного метаболита цитратного цикла (см. с. 140). При избытке ацетил-КоА в печени образуются кетоновые тела (см. с. 304).(жирные кислоты при наличии углеводов окисляются в митохондриях) Б. Энергетический баланс деградации жирных кислот Итак, при утилизации одной молекулы пальмитиновой кислоты синтезируются 106 молекул АТФ, что соответствует свободной энергии 3300 кДж/моль (106 х 30,5 кДж/моль АТФ). Выигрыш в энергии при деградации жирных кислот существенно выше по сравнению с распадом углеводов (32 молекулы АТФ на 1 молекулу глюкозы) и белков даже с учетом больших размеров молекул. Поэтому жиры представляют собой очень выгодную форму сохранения энергии. http://www.xumuk.ru/biochem/300.html Сердце и нервная ткань используют глюкозу в качестве источника энергии. Клетки сердечной мышцы являются в известном смысле "всеядными", так как они могут получать энергию и из других субстратов Б. Фаза пострезорбции При прекращении поступления пищи вскоре начинается фаза пострезорбции. Эта стадия начинается с изменения секреции гормонов поджелудочной железы: теперь А-клетки секретируют больше глюкагона, а В-клетки прекращают секрецию инсулина. Низкое соотношение инсулин/глюкагон в плазме крови запускает процесс промежуточного метаболизма в обратном направлении. Теперь организм должен вернуться к использованию собственных энергетических резервов. В организме начинается расщепление запасных веществ — гликогена, жиров, белков, и запускается производство макроэргических субстратов в печени. В печени происходит мобилизация гликогена (гликогенолиз, см. с. 158), Полученная глюкоза используется для обеспечения других тканей, прежде всего мозга, коры надпочечников и эритроцитов, не располагающих собственными резервами глюкозы. Если спустя несколько часов резервы глюкозы в печени окажутся исчерпанными, усиливается процесс глюконеогенеза (см. с. 156). Субстраты поступают из мышц (аминокислоты) и жировой ткани (глицерин). Высвободившиеся жирные кислоты используются печенью для синтеза кетоновых тел (кетогенез, см. с. 304), которые направляются в кровь и служат важнейшим источником энергии в пострезорбционной фазе. В мышцах разнообразные резервы глюкозы используются исключительно для собственных нужд (см. с. 238). Аминокислоты, образующиеся за счет медленного расщепления белков, поступают в печень и утилизируются в процессе глюконеогенеза. В жировой ткани гормоны инициируют липолиз с образованием глицерина и жирных кислот. Жирные кислоты служат источником энергии во многих тканях (за исключением мозга и эритроцитов). Важным приемником жирных кислот является печень, где они используются для синтеза кетоновых тел. (жир является источником двух видов сырья) 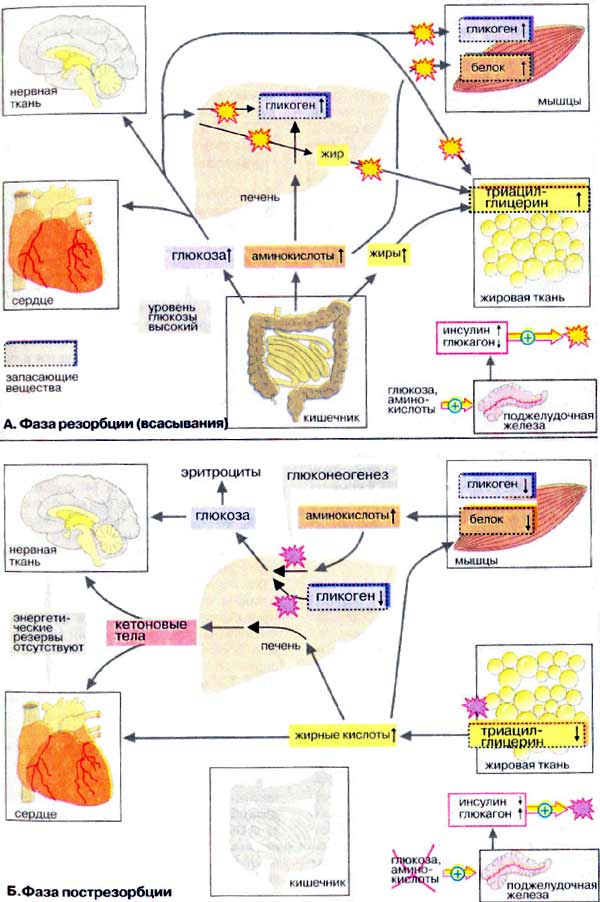 http://www.xumuk.ru/biochem/302.html А. Глюконеогенез: общие сведения Синтез глюкозы de novo (до 250 г в сутки (на голоде до 80 г.)) происходит в основном в печени (в мирной жизни). Процесс глюконеогенеза может идти и в почках, однако из-за небольших размеров почек их вклад в синтез глюкозы составляет всего 10%. (на голоде – 45%) Глюконеогенез контролируется гормонами. Кортизол, глюкагон и адреналин стимулируют этот процесс, а инсулин, напротив, подавляет. При глюконеогенезе в печени наиболее важными субстратами являются лактат, поступающий из мышечной ткани и эритроцитов, аминокислоты из желудочно-кишечного тракта (глюкогенные аминокислоты) и мышц (аланин), а также глицерин из жировых тканей. В почках в качестве субстрата служат главным образом аминокислоты (см. с. 320). Жирные кислоты и другие источники ацетил-КоА не могут использоваться в организме млекопитающих для биосинтеза глюкозы, поскольку ацетил-КоА, образующийся при бета-окислении в цитратном цикле (см. с. 140), полностью окисляется до СО2, в то время как в глюконеогенезе исходным продуктом является оксалоцетат. http://www.xumuk.ru/biochem/304.html А. Метаболизм липидов В фазе пострезорбции (см. с. 300), особенно в период поста или голодания, обмен липидов идет в обратном направлении, организм обращается к собственным запасам. В этих условиях жиры поступают из жировой ткани в кровь, переносятся в печень, распадаются в результате бета-окисления до ацетил-КоА и, наконец, превращаются в кетоновые тела. Б. Биосинтез кетоновых тел Кетоновые тела поступают из печени в кровь, где они хорошо растворимы. Концентрация кетоновых тел в крови возрастает в фазе пострезорбции (фаза голодания). Наряду с жирными кислотами 3-гидроксибутират и ацетоацетат в этот период являются основными энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через легкие. После 1-2 недели голодания кетоновые тела начинают использоваться в качестве источника энергии нервными тканями. Однако при этом для обеспечения цитратного цикла необходимо минимальное количество глюкозы. (жирные кислоты и кетоны используются как топливо, но для «растопки» нужна глюкоза) http://www.xumuk.ru/biochem/330.html А. Циклы Кори и аланина В клетках, не содержащих митохондрий (например, в эритроцитах), или в тканях при недостаточном снабжении кислородом (например, в активно работающих мышцах) АТФ (АТР) синтезируется за счет процесса превращений глюкозы в лактат, т. е. за счет процесса брожения (= анаэробного гликолиза, см. рис. 153). Лактат переносится кровью в печень, где в процессе глюконеогенеза с затратой АТФ (см. рис. 157) вновь конвертируется в глюкозу (цикл Кори). При интенсивной работе мышцы максимально активируется гликолиз. Продукт гликолиза, пировиноградная кислота (пируват) накапливается в цитоплазме и недостаточно быстро поступает в митохондрии, если они из-за недостатка кислорода не готовы к окислению пирувата. В анаэробных условиях пируват в реакции, катализируемой лактатдегидрогеназой (см. рис. 103) (заключительный этап гликолиза) восстанавливается до лактата. … Лактат диффундирует в кровь и поступает в печень, где конвертируется в глюкозу. Таким образом, образование лактата временно заменяет аэробный метаболизм глюкозы и частично переносит этот процесс из мышц в печень. Обратная связь, подобная циклу Кори, существует в цикле аланина, в котором также участвует пируват. Цикл аланина берет начало с протеолиза белков. Образующиеся аминокислоты в результате трансаминирования в присутствии ферментов превращаются в бета-кетокислоты (на схеме не приведено, см. рис. 181), которые в основном включаются в цикл трикарбоновых кислот (цитратный цикл) (см. рис. 183).Одновременно в реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот переносятся на имеющийся субстрат, пируват. Образующийся аланин поступает в кровь и переносится в печень. Таким образом, цикл аланина служит каналом передачи азота и предшественников глюкозы в печень, которая является местом синтеза конечных продуктов азотистого обмена, например мочевины (см. рис. 185). Следует напомнить, что при анаэробном гликолизе образуются кислоты, которые, не принимая участие в последующем обмене, существуют в форме анионов. Поэтому при интенсивном анаэробном гликолизе рН мышечной клетки может понизиться настолько, что сокращение станет невозможным. Обычно этого не происходит благодаря быстрому выходу кислых метаболитов (лактата и пирувата) в кровь, которая также может оказаться закисленной (метаболический ацидоз) Б. Метаболизм белков и аминокислот Скелетные мышцы активно участвуют в метаболизме аминокислот. Это наиболее важный участок деградации разветвленных аминокислот (Val и Ile, см. с. 402). Ряд других аминокислот также деградируются преимущественно в мышцах. Одновременно идет ресинтез и высвобождение в кровь аланина и глутамина. Эти аминокислоты служат переносчиками азота, образующегося при расщеплении белков, в печень (цикл аланина) и почки (см. рис. 319). При голодании мышечные белки служат энергетическим резервом организма. Они гидролизуются до аминокислот, которые поступают в печень. Здесь углеродный скелет аминокислот конвертируется в промежуточные продукты цитратного цикла, в том числе в ацетоацетил-КоА и ацетил-КоА (см. рис. 183). Эти амфиболические соединения окисляются в цикле трикарбоновых кислот или включаются в процесс глюконеогенеза. (белки также являются топливом) Синтез и расщепление мышечных белков контролируются гормонами. Тестостерон и синтетические анаболики стимулируют биосинтез белка; напротив, кортизол подавляет образование мышечных белков. 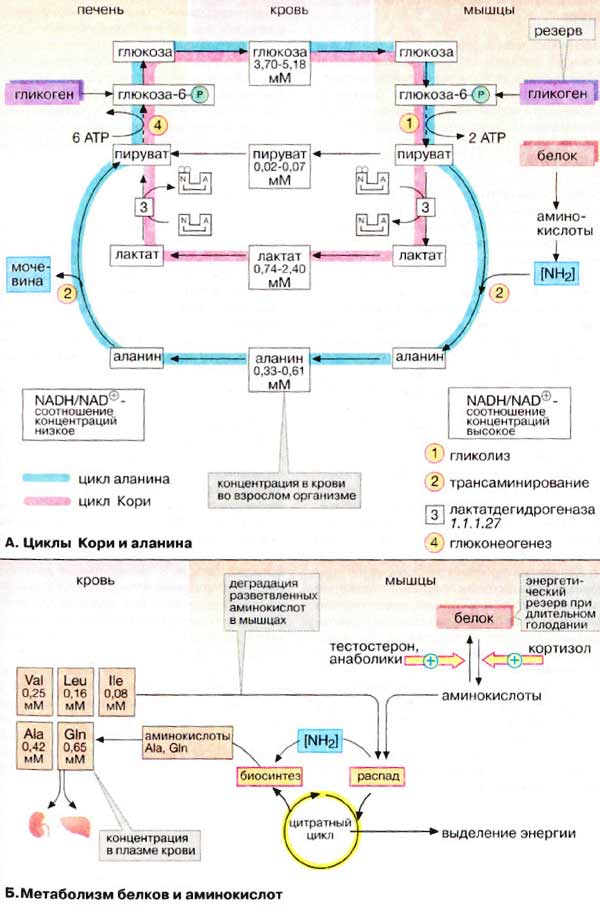 Последний раз редактировалось Vovec; 10-07-2010 в 17:03.. Причина: Ссылка на тему "Биохимия" |
|
|

|
| 21 пользователей сказали Vovec спасибо за это полезное сообщение: |
alagor (12-12-2009),
ASDF (16-03-2009),
Chudo-Yudo (13-07-2011),
inter (01-09-2009),
Ludmila_ (17-03-2009),
Maksenek (16-07-2012),
obelix (16-03-2009),
Olyy (31-03-2011),
Penelopa (19-03-2009),
pupsik (09-02-2011),
riskon (12-12-2009),
Stendal (20-04-2010),
Sytyj (27-02-2010),
Алена (16-03-2009),
Владомир (18-04-2017),
Елена_Ф (24-12-2009),
Мадам Фрекенбок (25-03-2009),
Семка (09-11-2009),
Слуцкий (08-06-2009),
троль (12-11-2009),
Эльвира (01-09-2009)
|
|
|
#2 |
|
Администратор
Регистрация: Nov 2006
Адрес: Израиль
Сообщений: 9,349
Поблагодарил: 713
Поблагодарили 6,072 раз(а) в 6,722 сообщениях Файловый архив: 54
Закачек: 12
|
http://www.xumuk.ru/biologhim/158.html Жировая ткань и ее участие в обмене липидов Известно, что главным источником жирных кислот, используемых в качестве «топлива», служит резервный жир, содержащийся в жировой ткани. Принято считать, что триглицериды (собственно жир) жировых депо выполняют в обмене липидов такую же роль, как гликоген в печени в обмене углеводов (т.е. упаковка), а высшие жирные кислоты по своей энергетической роли напоминают глюкозу (само топливо), которая образуется в процессе фосфоролиза гликогена. При физической работе и других состояниях организма, требующих повышенных энергозатрат, потребление триглицеридов жировой ткани как энергетического резерва увеличивается. Липолиз триглицеридов в жировой ткани . В качестве источника энергии могут использоваться только свободные, т.е. неэстерифицированные, жирные кислоты. Поэтому триглицериды сначала гидролизуются при помощи специфических тканевых ферментов – липаз – до глицерина и свободных жирных кислот. Последние из жировых депо могут переходить в плазму крови (мобилизация высших жирных кислот), после чего они используются тканями и органами тела в качестве энергетического материала. http://www.xumuk.ru/biologhim/159.html Окисление жирных кислот Установлено, что окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани (т.е. эти ткани могут питаться жирными кислотами). В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза. (на голоде – кетоновые тела) http://www.xumuk.ru/biologhim/162.html Метаболизм кетоновых тел Кетоновые тела образуются в печени. Прежние представления о том, что кетоновые тела являются промежуточными продуктами β-окисления жирных кислот, оказались ошибочными. (печень их специально вырабатывает) …………………………………………………………………………………………………. В настоящее время ясна молекулярная основа изречения, что «жиры сгорают в пламени углеводов». Известно, что ацетил-КоА, образовавшийся при окислении жирных кислот, включается в цикл трикарбоновых кислот в условиях, когда расщепление жиров и углеводов соответствующим образом сбалансировано. Включение ацетил-КоА в цикл Кребса зависит от доступности оксалоацетата для образования цитрата. Однако если расщепление жиров преобладает, судьба ацетил-КоА изменяется. Объясняется это тем, что в отсутствие углеводов или при нарушении их использования концентрация оксалоацетата снижается. При голодании или диабете оксалоацетат расходуется на образование глюкозы и поэтому не может конденсироваться с ацетил-КоА. В таких условиях путь метаболизма ацетил-КоА отклоняется в сторону образования ацетоацетата и D-3-гидрокси-бутирата, т.е. кетоновых тел. В крови здорового человека кетоновые тела содержатся лишь в очень небольших концентрациях (в сыворотке крови 0,03–0,2 ммоль/л). При патологических состояниях (у лиц с тяжелой формой сахарного диабета, при голодании, а также у животных с экспериментальным острым стрептозотоциновым или аллоксановым диабетом) концентрация кетоновых тел в сыворотке крови увеличивается и может достигать 16–20 ммоль/л. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала. Как отмечалось, основным местом образования ацетоацетата и 3-гидроксибутирата служит печень. Из митохондрий печени эти соединения диффундируют в кровь и переносятся к периферическим тканям. Действительно, сердечная мышца и корковый слой почек предпочтительно используют в качестве «топлива» ацетоацетат, а не глюкозу. В противоположность этому глюкоза является главным «топливом» для мозга у лиц, получающих сбалансированную пищу. При голодании и диабете мозг адаптируется к использованию ацетоацетата. Установлено, что в условиях длительного голодания 75% потребности мозга в «топливе» удовлетворяется за счет ацетоацетата. http://www.xumuk.ru/biologhim/256.html Метаболический ацидоз – самая частая и тяжелая форма нарушений кислотно-основного равновесия. Он обусловлен накоплением в тканях и крови органических кислот. Этот вид ацидоза связан с нарушением обмена веществ. Метаболический ацидоз возможен при диабете, голодании, лихорадке, заболеваниях пищеварительного тракта, шоке (кардиогенном, травматическом, ожоговом и др.). Особенно явно метаболический ацидоз проявляется у больных тяжелой формой диабета и не получающих инсулина. Увеличение кислотности обусловлено поступлением в кровь больших количеств кетоновых тел. В ответ на постоянную выработку кетоновых тел (β-оксимасляной и ацето-уксусной кислот) в организме компенсаторно снижается концентрация Н2СО3 – донора протонов в бикарбонатной буферной системе. Снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 легкими (напомним, что Н2СО3 обратимо диссоциирует на СО2 и Н2О). Однако при тяжелом диабете для компенсации ацидоза легкие должны выделять настолько большие количества СО2, что концентрация Н2СО3 и НСО3– становится крайне низкой и буферная емкость крови значительно уменьшается. Все это приводит к неблагоприятным для организма последствиям. При метаболическом ацидозе кислотность мочи и концентрация аммиака в моче увеличены. http://www.xumuk.ru/biologhim/305.html Источники энергии мышечной деятельности При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов (см. главу 16). Перечисленные механизмы ресин-теза АТФ при мышечной деятельности включаются в строго определенной последовательности. Наиболее экстренным является креатинкиназный механизм, и лишь примерно через 20 с максимально интенсивной работы начинается усиление гликолиза, интенсивность которого достигает максимума через 40–80 с. При более длительной, а следовательно, и менее интенсивной работе все большее значение приобретает аэробный путь ресинтеза АТФ. Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ велик. В связи с этим ресинтез АТФ в миокарде должен происходить намного интенсивнее, чем в скелетной мускулатуре. Для сердечной мышцы теплокровных животных и человека основным путем образования богатых энергией фосфорных соединений является путь окислительного фосфорилирования, связанный с поглощением кислорода. Регенерация АТФ в процессе анаэробного расщепления углеводов (гликолиз) в сердце человека практического значения не имеет. Именно поэтому сердечная мышца очень чувствительна к недостатку кислорода. Характерной особенностью обмена веществ в сердечной мышце по сравнению со скелетной является также то, что аэробное окисление веществ неуглеводной природы при работе сердечной мышцы имеет большее значение, чем при сокращении скелетной мышцы. Только 30–35% кислорода, поглощаемого сердцем в норме, расходуется на окисление углеводов и продуктов их превращения. Главным субстратом дыхания в сердечной мышце являются жирные кислоты. Окисление неуглеводных веществ обеспечивает около 65–70% потребности миокарда в энергии. Из свободных жирных кислот в сердечной мышце особенно легко подвергается окислению олеиновая кислота. Из еще одной статьи по биохимии http://dwb.unl.edu/Teacher/NSF/C10/C...hways/801.html Review of Energy Physiology a. the brain requires glucose (it can use ketone bodies during starvation) b. muscles, when at rest, use fatty acids; when exercising they use glycogen and can produce lactate when oxygen levels are limiting. c. liver (the glucose buffer) converts lactate to glucose d. adipose tissue needs glucose for triglyceride synthesis; low glucose leads to release of fatty acids. Также исследование Fasting: The History, Pathophysiology and Complications, эта статья есть в списке литературы в методичке минздрава. В отличие от большинство других исследований с участием людей с ожирением данном исследовании 36-и дневного голода участвовал человек с нормальным весом, монах, 41 год, рост 172, вес 67 кг, оволактовегетарианец. Хотя такой вес и не считается ожирением, но и атлетом испытуемый не являлся. Ежедневно он съедал 20 г. пресного хлеба как причастие. Physical Adaptations to Fasting The subject fasted for 36 days until profound weakness and symptoms of postural hypotension interfered with his daily activities in the monastery. Weight Loss He lost 15.7 kg or 22.9 percent of his initial body weight after 36 days of acaloric fasting. Weight loss continued through the first two days of realimentation, resulting in a total weight loss of 16.6 kg or 24.2 percent of initial body weight.The rate of weight loss was initially 0.9 kg per day for the first five days, then it radually decreased over the next two weeks and became stable at 0.3 kg per day after the third week.(Много для не толстого человека после второго криза. Можно предположить, что ежедневное потребление куска хлеба осложнило ход голодания) The total weight loss and the rate of loss compare favorably with those reported elsewhere: In the initial fasting period (one to five days), weight loss occurs at the rate of 1 to 2 kg per day followed by a gradual decline through the third week, thereafter averaging 0.3 kg per day.30 In Benedict's study," Mr. L lost 13.25 kg or 21.9 percent of initial body weight after 31 days of fasting. This compares with a 14.2-kg loss or 20.7 percent of initial body weight after the same time in our subject (Figure 1). Natriuresis The early high rate of weight loss in our subject cannot be explained on the basis of energy expenditure alone. If the initial 0.9 kg per day weight loss observed were to reflect loss of body fat, carbohydrate and protein, it would require an energy expenditure of 3,150 calories per day. This is far in excess of the basal energy expenditure of 1,673 calories per day predicted for this man in the early fasting period (но и эта цифра представляется завышенной). It is now well established that early accelerated weight loss during fasting is the result of salt and water diuresis. Участвовало 11 человек с весом 110-180 кг., длительность голодания 35-40 дней. The amount of glucose derived from amino acids can be estimated from urinary nitrogen excretion or from a-amino nitrogen differences across the liver and kidney. 1 g of nitrogen is equal to 6.25 g of protein (В мышцах 20% белка, значит потеря 30 г. белка означает потерю 150 г. мышц, при условии, что это единственный его источник), and theoretically 4.66 g of nitrogen from catabolized protein should yield about 16 g of glucose. Approximately 26 g of glucose can be synthesized from the amino acids taken up by these organs as approximated by the arterio-venous differences in our studies. These estimates of glucose production are in reasonable agreement, since some of the amino acids taken up by the liver are ketogenic rather than glucogenic, and complete conversion of amino acids to glucose appears improbable. These obese subjects, fasted 5-6 wk. mobilize approximately 190 g of triglyceride/dav, as calculated by indirect calorimetry' yielding 19 g of glycerol from adipose tissue which can serve as a glucose precursor. In the present study the liver and kidneys together removed approximately 213 mmoles or 19 g of glycerol from the blood per day, capable of producing 19 g of glucose, a surprising agreement. Последний раз редактировалось Vovec; 16-07-2012 в 13:36.. |
|
|

|
| 11 пользователей сказали Vovec спасибо за это полезное сообщение: |
Chudo-Yudo (13-07-2011),
inter (01-09-2009),
Ludmila_ (24-03-2009),
Maksenek (16-07-2012),
Olyy (31-03-2011),
Reasonable (27-10-2014),
riskon (12-12-2009),
Гвоздь (09-07-2010),
Елена_Ф (24-12-2009),
Мадам Фрекенбок (25-03-2009),
Слуцкий (08-06-2009)
|
|
|
#3 | ||
|
Администратор
Регистрация: Nov 2006
Адрес: Израиль
Сообщений: 9,349
Поблагодарил: 713
Поблагодарили 6,072 раз(а) в 6,722 сообщениях Файловый архив: 54
Закачек: 12
|
Re: Голодание
Энергозапасы и потребности организма Гликоген – вес печени 1.5 кг. Содержание гликогена в ней по разным источникам колеблется от 2-8% (http://www.xumuk.ru/biologhim/236.html) до 20% (http://www.xumuk.ru/biochem/298.html). Цитата:
Т.е. от 30-120 и до 300 грамм. Содержание гликогена в мышцах от 0.3-2% (http://www.xumuk.ru/biologhim/301.html , http://www.xumuk.ru/biochem/328.html) Эта величина очень сильно связана с физической формой человека. Спорстмены прибегают к специальным тренировкам для накопления гликогена в мышцах перед соревнованиями. В частности Цитата:
Считается, что вес мышц у человека 40% от массы тела (http://www.xumuk.ru/biologhim/296.html), но, разумеется, это показатель очень сильно зависит от физ.формы, возраста, веса, пола. Содержание белка в мышцах примерно 20% по весу. По официальным нормам количество жира в организме должно быть около 20%. Рассмотрим следующую таблицу: Энергозапасы здоровых людей* Источник................................кг........калории..........% от общих запасов Жир.......................................15.0.......141 000...........85.00 Белок (в основном мышцы)..6.0.........24 000...........14.50 Гликоген (мышцы).................0.150..........600............0.35 Гликоген (печень)..................0.075..........300............0.15 *Cahill GF Jr, Owen OE, Morgan AP: The consumption of fuels during prolonged starvation. Adv Enzyme Regul 1968: 6: 143-150 Согласно этой таблице гликогена в печени 5%, в мышцах примерно 0.5%. Очевидно, что в даннм случае речь идет далеко не о штангистах-олимпийцах. Судя по количеству жира и мышц исследовались люди весом примерно 70 кг. Если учесть, что к голоданию приходят далеко не самые крепкие и здоровые люди, то для кого-то и эти цифры могут быть завышенными. Но в любом случае, даже если принять запасы гликогена в несколько раз больше табличных, то, по сравнению с жиром и белками, запас энергии будет очень мал. Из этой же таблицы получаем другую: Калорийность (ккал) на 100 грамм Гликоген.............400 Жир.....................940 Белок..................400 Последний раз редактировалось Vovec; 26-05-2009 в 13:54.. |
||
|
|

|
| 14 пользователей сказали Vovec спасибо за это полезное сообщение: |
|
|
#4 | ||
|
Администратор
Регистрация: Nov 2006
Адрес: Израиль
Сообщений: 9,349
Поблагодарил: 713
Поблагодарили 6,072 раз(а) в 6,722 сообщениях Файловый архив: 54
Закачек: 12
|
О закислении, ощелачивании и методе Бутейко В различной ЗОЖевской литературе много обсуждается тема закисления организма, кислотных и щелочных продуктов, вымывания кальция. Давайте рассмотрим эти вопросы с точки зрения биохимии. Есть соответствующая тема: Фрукты ощелачивают или окисляют? Как всегда, для начала рассмотрим теоретический материал. http://www.rmj.ru/articles_2114.htm Эндогенное образование кислот Жиры и углеводы метаболизируются с образованием воды и углекислого газа, который удаляется через легкие. В результате метаболизма белков помимо углекислого газа образуются разнообразные нелетучие кислоты, которые в норме экскретируются почками. Катаболизм серосодержащих аминокислот, цистеина и метионина, приводит к образованию 40 – 70 ммоль серной кислоты в сутки. В результате метаболизма катионных аминокислот, гистидина, лизина, аргинина за сутки высвобождается 138 ммоль свободных анионов. В то же время катаболизм анионных аминокислот обусловливает поступление 100 ммоль оснований за сутки. Помимо этого, в пище содержатся органические анионы, такие как ацетат, цитрат, лактат и другие, которые метаболизируются с образованием бикарбоната в количестве 60 ммоль/сут. В целом обмен белков приводит к образованию около 500 ммоль кислот, которые в норме экскретируются почками. Высокий уровень потребления мясных продуктов приводит к увеличению продукции кислот и кислотообразующих катионных аминокислот. И, напротив, растительная пища содержит большое количество органических бикарбонатобразующих анионов, таких как цитрат, лактат и др. Таким образом, суточная экскреция кислот может значительно колебаться в зависимости от диеты. http://www.rusmedserver.ru/med/haris/42.html Ацидоз и алкалоз В организме в норме в процессе метаболизма постоянно образуются кислоты. Несмотря на ежедневное образование в тканевых жидкостях около 20000 ммолей угольной и 80 ммолей сильных кислот, концентрация свободных ионов водорода находится в узком диапазоне. В норме рН внеклеточной жидкости составляет 7,35—7,45 (45—35 нмоль/л). Определить точно рН во внутриклеточных жидкостях невозможно. По данным, полученным с помощью большинства существующих методов, эта величина в среднем составляет 6,9. .... Основным источником появления сильной (серной) кислоты служит метаболизм метионина и цистина, входящих в состав белков пищи. К другим источникам относят неполное окисление углеводов и жиров до органических кислот, обменные превращения нуклеопротеинов с образованием мочевой кислоты, метаболизм фосфорорганических веществ, в процессе которого высвобождаются протоны и неорганические фосфаты. В рационе питания количество готовых кислот или щелочей обычно невелико, но может содержаться достаточное количество потенциальных кислот (например, избыток катионных кислот, таких как лизин) или щелочей (например, цитрат). http://www.xumuk.ru/biochem/280.html Б. Кислотно-основной баланс Существуют два источника протонов — свободные кислоты пищи и серосодержащие аминокислоты белков, полученные с пищей кислоты, например лимонная, аскорбиновая и фосфорная, отдают протоны в кишечном тракте (при щелочном рН). В обеспечение баланса протонов наибольший вклад вносят образующиеся при расщеплении белков аминокислоты метионин и цистеин. В печени атомы серы этих аминокислот окисляются до серной кислоты, которая диссоциирует на сульфат-ион и протоны. В. Буферные системы плазмы Наиболее важной буферной системой плазмы является бикарбонатный буфер, состоящий из слабой угольной кислоты (рК1 6,1) и ее кислого аниона бикарбоната. Угольная кислота Н2СО3 находится в равновесии со своим ангидридом СО2. Установление равновесия между обеими формами ускоряется ферментом карбонат-дегидратазой ("карбоангидразой"). При рН плазмы концентрации НСО3- и СО2 находятся в соотношении 20/1. Растворенный в крови СО2 равновесно обменивается с СО2 газовой фазы альвеол легких. Поэтому НСО3-/СО2 -система является эффективной открытой буферной системой. Ускоренное или замедленное дыхание изменяет концентрацию СО2, что приводит к изменению рН плазмы (дыхательный ацидоз или соответственно алкалоз). Таким образом, легкие могут быстро и действенно влиять на рН плазмы без участия систем удаления протонов. http://www.xumuk.ru/biochem/318.html Секреция протонов 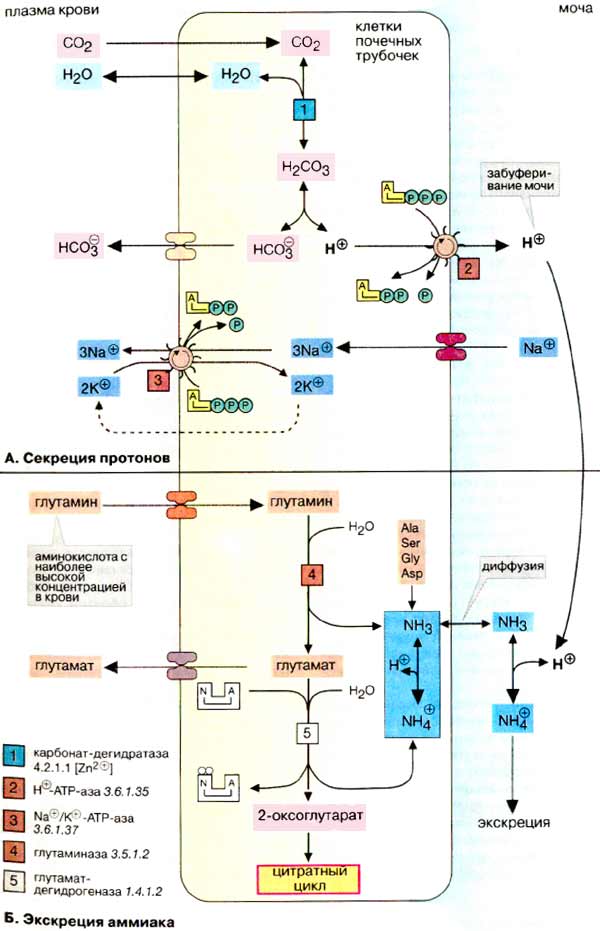 из крови в клетки почечных трубочек диффундирует диоксид углерода (СО2), который в цитоплазме гидратируется при участии карбонат-дегидратазы (карбоангидразы) [1] с образованием Н2СО3, диссоциирующей на ион бикарбоната (НСО3-) и протон. Протон секретируется из цитоплазмы в просвет канальца мембранной транспортной АТФ-зависимой системой [2], а ион бикарбоната всасывается через базолатеральную мембрану обратно в кровь. Для сохранения электронейтральности из канальца в кровь за счет реабсорбции переносятся ионы Na+. Суммарный процесс состоит в переносе протонов из крови в обмен на ионы Na+. Тем самым почки принимают участие в поддержании стабильного рН плазмы крови (равновесия СО2/НСО3-) (см. рис. 281). …………………………. в моче большая часть протонов нейтрализуется буферными системами, поэтому рН мочи лежит в слабокислой области (примерно до 4,8) Наиболее важной буферной системой является фосфатная (НРО42- / Н2РО4-). Определенный вклад в поддержание величины рН вносит аммиак за счет образования ионов аммония. http://www.xumuk.ru/biologhim/255.html Буферные системы крови При нормальном значении рН крови (7,4) концентрация ионов бикарбоната НСО3 в плазме крови превышает концентрацию СО2 примерно в 20 раз. Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4. Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции (напомним, что концентрация Н2СО3 в плазме крови определяется давлением СО2 в альвеолярной газовой смеси). Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких . Как будет показано далее, данная буферная система тесно связана с гемоглобиновой системой. http://www.xumuk.ru/biologhim/256.html Нарушения кислотно-основного равновесия Снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 легкими (напомним, что Н2СО3 обратимо диссоциирует на СО2 и Н2О). Однако при тяжелом диабете для компенсации ацидоза легкие должны выделять настолько большие количества СО2, что концентрация Н2СО3 и НСО3– становится крайне низкой и буферная емкость крови значительно уменьшается. Все это приводит к неблагоприятным для организма последствиям. http://www.xumuk.ru/biologhim/269.html Роль почек в поддержании кислотно-основного равновесия Почки оказывают значительное влияние на кислотно-основное равновесие, но оно сказывается по истечении значительно большего времени, чем влияние буферных систем крови и легких. Влияние буферных систем крови обнаруживается в течение 30 с. Легким требуется примерно 1–3 мин, чтобы сгладить наметившийся сдвиг концентрации водородных ионов в крови, почкам необходимо около 10–20 ч для восстановления нарушенного кислотно-основного равновесия. Второй химический процесс, который обеспечивает задержку натрия в организме и выведение излишка водородных ионов,– это превращение в просвете канальцев бикарбонатов в угольную кислоту. В клетках канальцев при взаимодействии воды с углекислым газом под влиянием карбоан-гидразы образуется угольная кислота. Водородные ионы угольной кислоты выделяются в просвет канальца и соединяются там с анионами бикарбоната; эквивалентный этим анионам натрий поступает в клетки почечных канальцев. Образовавшаяся в просвете канальца Н2СО3 легко распадается на СО2 и Н2О и в таком виде покидает организм. Глинка, "Общая химия", раздел 92, "Гидролиз солей", стр. 249: "растворы солей, образованных слабой кислотой и сильным основанием, имеют щелочную реакцию" Цитата:
Теперь о связи вопроса с методикой Бутейко. Употребление белковой пищи (ну или её избыток) усиливает дыхание, и снижает ацидоз за счет вывода СО2. См. http://ru.wikipedia.org/wiki/Гипокапния. Принудительное уменьшение дыхания задерживает углекислый газ, но одновременно увеличивает ацидоз. В каких-то ситуациях это может и нужно, но в любом случае до какого-то предела. Соответственно, для облегчения тренировки по Бутейко нужно снизить кислотную нагрузку на организм. Да сам Константин Павлович говорит об этом же: «Переедание, особенно животных белков (рыба, курица, яйца, молоко и, естественно, мясо), резко усиливает дыхание. Заметим, что животные продукты усиливают дыхание больше, растительные - меньше; вареная пища - больше, сырая - меньше. … основные положения традиционной медицины: … калорийней питаться - усиливают дыхание». Хотелось бы заметить, что согласно вышесказанному, любая пища усиливает дыхание, в том числе и сырая растительная, только меньше чем животная вареная. Как следует из всяческих биохимических выкладок, кальций в регуляции кислотно-основного равновесия крови не участвует и никуда не вымывается. Что прекрасно согласуется с фактом, что северные народы потребляющие много мяса менее подвержены остеопорозу. При сильном ацидозе выведение кальция усиливается, но это только «в военное время», а в штатном режиме он никуда не «вымывается». Вот что влияет на вывод кальция с мочой, так это уровень инсулина, который препятствует его реабсорбции в почках. А уровень инсулина напрямую связан с потреблением углеводов, особенно быстрых. Таким образом тезис, что сахар вымывает кальций в принципе верен, но дело не в сахаре как таковом, а в уровне инсулина. А «мёртвый» ли это сахар (который впрочем производится из очень даже живой свёклы) или «живой» фрукт – на уровень инсулина это никак не влияет. Цитата:
__________________
Памятка новичку - всё, что вы хотели узнать о форуме, но боялись спросить  Методичка по голоданию - обобщение практического опыта форума. Энциклопедия - теория и практика голодания и ЗОЖ. Последний раз редактировалось Vovec; 21-10-2009 в 06:31.. |
||
|
|

|
| 14 пользователей сказали Vovec спасибо за это полезное сообщение: |
|
|
#5 |
|
Администратор
Регистрация: Nov 2006
Адрес: Израиль
Сообщений: 9,349
Поблагодарил: 713
Поблагодарили 6,072 раз(а) в 6,722 сообщениях Файловый архив: 54
Закачек: 12
|
Re: Биохимия
Ацидоз на голоде Рассмотрим вопрос ацидоза во время голодания, концентрации СО2 (в свете метода Бутейко) и влияния небольшого количества глюкозы на распад мышц. Для затравки: Survival in starvation Protein, fat, and carbohydrate requirements during starvation: anaplerosis and cataplerosis The Effect of Carbohydrates on Ammonium and Ketoacid Excretion during Starvation Об ацидозе на форуме сломано много копий, но давайте взглянем на результаты инструментальных исследований. В статье The Effect of Carbohydrates on Ammonium and Ketoacid Excretion during Starvation примерно через 2-3 недели у полных пациентов рН венозной крови был 7.32-7.31. Исходя из http://www.emedmag.com/html/pre/fea/.../038120044.asp можно предположить у этих пациентов рН артериальной крови7.35, что является нижней границей нормы - http://en.wikipedia.org/wiki/Metabol...osis#Diagnosis. Также из http://www.brooksidepress.org/Produc...alBloodGas.htm следует нормальный рН венозной крови 7.31-7.41 В другом исследовании Protein, fat, and carbohydrate requirements during starvation: anaplerosis and cataplerosis рН артериальной крови на 18-й и 21-й дни был 7.36-7.34. У голодающих понизились уровень как PCO2 (растворенный углекислый газ) до 33 (норма 41-51), так и НСО3 (угольная кислота) до 17 (речь об уровнях в венозной крови). Таким образом, можно сделать вывод, что ацидоза как такового, по крайней мере, на сроках порядка двух-трех недель (после первого криза?) нету, и закисление за счет кетоновых тел компенсируется снижением уровня угольной кислоты. С позиции метода Бутейко есть некая неясность. С одной стороны, анализы однозначно указывают на падение уровня СО2 в крови. С другой стороны, много голодающих отмечают рост КП. У меня самого на 28-м дне появились явления, которые в дальнейшем вызывались именно снижением объема дыхания. В качестве гипотезы предположу, что либо на более поздних сроках уровень СО2 всё же растет, либо на голоде повышается чувствительность капилляров к действию углекислого газа. Ну или происходит что-то еще. В общем истина где-то рядом.  О голодании и мышцах. В статьях Survival in starvation и Protein, fat, and carbohydrate requirements during starvation: anaplerosis and cataplerosis рассматривается вопрос об истощении мышц в ходе голодания. Отмечается, что у полных людей смерть в ходе голодания наступает при истощении мышечной массы, еще до окончания жировых запасов. Так в http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(69)92546-X/abstract приведен пример смерти от фибрилляции желудочков 20-и летней здоровой девушки, страдавшей ожирением. В момент смерти электролиты плазмы, кальций, магний, рН и давление газов в крови были в норме. Волокна сердечной мышцы были в диаметре вдвое меньше нормального, что значит четырехкратное снижение массы. Также под электронным микроскопом выявлена большая потеря и фрагментация миофибрилл. К сожалению, подробности неизвестны, точнее за них надо заплатить 31.50$.  Отмечается, что бурые медведи, императорские пингвины и морские слоны выдерживают длительное голодание без развития значительного кетоза (в 5-8 раз меньше, чем у человека) и мышечного истощения (не обнаруживается вывод азота с мочой). Потеря белка человеком предположительно вызвана либо нехваткой глюкозы, образующейся из глицерина (составляющей жира), либо потерей промежуточных продуктов в цикле Кребса. В эксперименте The Effect of Carbohydrates on Ammonium and Ketoacid Excretion during Starvation голодающим пациентам после двух-трех недель голода давали по 7.5 и 15 грамм глюкозы ежедневно. Даже прием три раза в день 2.5 грамм глюкозы значительно сокращал потерю организмом белка. Правда, влияние этого процесса на оздоровительный аспект голодания неизвестно. Но, возможно, такая малая углеводная поддержка сможет продлить срок голодания или сократить потерю мышц.
__________________
Памятка новичку - всё, что вы хотели узнать о форуме, но боялись спросить  Методичка по голоданию - обобщение практического опыта форума. Энциклопедия - теория и практика голодания и ЗОЖ. Последний раз редактировалось Vovec; 01-05-2011 в 17:30.. |
|
|

|
| 24 пользователей сказали Vovec спасибо за это полезное сообщение: |
alagor (12-12-2009),
Alena4 (26-12-2009),
Astrid (24-12-2009),
bum (17-12-2022),
Chudo-Yudo (13-07-2011),
Corlack (11-08-2014),
DenisT (02-06-2013),
Fruct (12-12-2009),
kirti (29-04-2011),
Limonchik (07-03-2010),
Madlen (27-04-2010),
Maksenek (16-07-2012),
mark (12-12-2009),
Reasonable (27-10-2014),
riskon (12-12-2009),
Valiant (22-09-2010),
Гвоздь (09-07-2010),
Елена_Ф (24-12-2009),
Львица (16-03-2010),
Микола2 (20-03-2011),
Постник (23-09-2010),
Рафис (22-06-2012),
троль (12-12-2009)
|
|
|
#6 |
|
Регистрация: Jun 2010
Адрес: Россия
Сообщений: 5,122
Поблагодарил: 18,208
Поблагодарили 25,763 раз(а) в 6,612 сообщениях Файловый архив: 2
Закачек: 0
|
Re: Биохимия
Динамика выведения натрия на 1-10 дни голодания (г/сут):
1. 2,32 (экв. 6.0 г соли) 2. 1,84 [-0,48] (экв. 4.7 г соли) 3. 1,77 [-0,07] (экв. 4.6 г соли) 4. 1,98 [+0,21] (экв. 5.1 г соли) 5. 1,95 [-0,03] (экв. 5.0 г соли) 6. 1,98 [+0,03] (экв. 5.1 г соли) 7. 1,87 [-0,11] (экв. 4.8 г соли) 8. 1,78 [-0,09] (экв. 4.6 г соли) 9. 1,67 [-0,11] (экв. 4.3 г соли) 10. 1,56 [-0,11] (экв. 4.0 г соли) Источник: "Metabolic Aspects of Acute Starvation in Normal Humans (10 Days)" http://ajcn.nutrition.org/content/20....full.pdf+html |
|
|

|
| 5 пользователей сказали Maksenek спасибо за это полезное сообщение: |
bum (17-12-2022),
Corlack (11-08-2014),
kayng18 (08-03-2023),
Reasonable (27-10-2014),
Инфинити (07-03-2020)
|
 |
| Здесь присутствуют: 3 (пользователей: 0 , гостей: 3) | |
|
|
 Похожие темы
Похожие темы
|
||||
| Тема | Автор | Раздел | Ответов | Последнее сообщение |
| Биохимия | ROM | Теория и практика голодания, вопросы и советы | 214 | 11-08-2010 02:16 |
| Биохимия от Путина | Putin_IRL | Библиотека | 2 | 02-05-2007 03:36 |
| Спонсорские ссылки: | |
|
|
|